Questions aux experts
Matière et matériaux
Comment fabriquer de l'oxygène et du gaz carbonique ?
Comment pourrait-on fabriquer facilement de l'oxygène en classe ?
Comment pourrait-on fabriquer facilement du gaz carbonique autrement que par notre respiration ?
En ce qui concerne la production de dioxygène, il me semble qu'une alternative assez simple à réaliser consiste en l'électrolyse d'une solution aqueuse saline (soude par exemple) à l'aide d'un générateur de courant continu (le courant alternatif conduirait à l'obtention de deux mélanges tonnants 2H2 + O2). Le gaz produit à l'anode (électrode reliée au pôle + du générateur) est du dioxygène (attention, la présence d'ions chlorures dans la solution saline mène à la production conjointe de dichlore avec certains types d'électrodes).
Je propose également de recueillir le gaz obtenu par décomposition de l'eau oxygénée concentrée (la dismutation du peroxyde d'hydrogène H2O2 conduit à H2O + 0.5 O2). La chaleur et diverses substances accélèrent cette décomposition : acides, bases, ions fer II, etc.
Si l'enseignant désire réaliser l'une de ces deux expériences, je pourrai lui donner quelques indications d'ordre expérimental supplémentaires.
Autre solution également facile à mettre en œuvre : faire agir une solution de permanganate de potassium acidifiée par un peu d'acide sulfurique sur une solution d'eau oxygénée (prendre de l'eau oxygénée à 10 ou 20 volumes du commerce ; ajouter un peu d'acide et quelques cristaux de permanganate de potassium) l'oxygène se dégage spontanément dans le tube ; on peut directement faire le test de combustion.
Au point de vue réaction chimique, il s'agit de l'oxydation de l'eau oxygénée (dans laquelle l'oxygène est au degré d'oxydation -1) en oxygène (degré d'oxydation 0) par l'ion MnO4- en milieu acide.
J'ai lu un certain nombre de réponses apportées aux questions des enseignants, en particulier celle qui concerne la production d'oxygène gazeux. Les méthodes indiquées sont tout à fait judicieuses. Il me semble cependant que la méthode le plus simple consiste à faire couler goutte à goutte dans une solution de soude à 10 %, à laquelle on a ajouté quelques cristaux (quelques milligrammes) de chlorure de cobalt, de l'eau oxygénée du commerce. Le dégagement d'oxygène commence aussitôt et on peut en régler le débit avec l'addition goutte à goutte de l'eau oxygénée. Le débit cesse dès qu'on interrompt l'addition d'eau oxygénée.
Vous souhaitez aborder ce sujet avec vos élèves ?
Consultez nos ressources pour la classe !









Pour l'oxygène, je préconise une méthode simple et efficace, qui demande seulement un produit de consommation courante, l'azote liquide. Il suffit de fabriquer un entonnoir conique en cuivre, dont le sommet est fermé et terminé par une structure pointue. On remplit ce cône d'azote liquide (température -192 °C) et l'oxygène de l'air, qui bout à -185 °C, se condense sur les parois externes du cône et coule goutte à goutte en bas le long de la pointe. Il suffit de le recueillir. Il existe d'autres méthodes, comme le chauffage de certains peroxydes ou chlorates, mais c'est un peu dangereux, et ça peut donner de mauvaises idées, le chlorate étant un produit courant de désherbage dont il vaut mieux ne pas trop montrer toutes les bêtises qu'on peut faire avec.
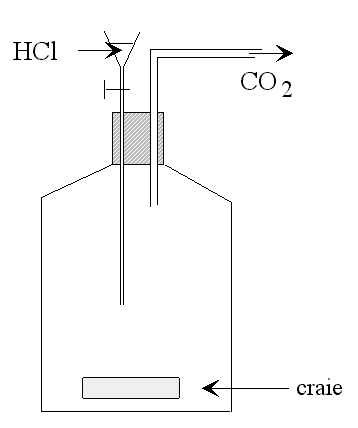
Pour ce qui est du gaz carbonique, il suffit de traiter du calcaire avec de l'acide chlorhydrique, ou même du vinaigre, pour obtenir autant de CO2 qu'on veut (voir figure).