Questions to the experts
Matière et matériaux
Dissolution de sel et de sucre dans l'eau
Nous voulons connaître, à des températures données, le seuil de saturation du sucre, du sel dans l'eau.
Il s'agit d'un travail entrepris en relation avec notre projet d'école : "démarche scientifique et ses applications dans le domaine technologique". Cette année, le travail est mené autour d'un thème commun, l'eau, et concerne tous les enfants de notre école, de la maternelle au CM2.
Les élèves de ma classe travaillent actuellement sur la notion de dissolution. Ils ont donc été conduits à réaliser diverses expériences à partir desquelles a été abordée, entre autres, la notion de saturation. Des expériences ont donc été mises en œuvre pour déterminer le seuil de saturation du sel, puis du sucre dans l'eau. Les résultats recueillis ne sont pas en accord avec ceux que nous avons rencontrés dans la documentation dont nous disposons. Aussi nous vous remercions de nous communiquer, pour au moins deux températures données, ce seuil. Nous pourrons ainsi entériner nos résultats, ou non.
Voici quelques données que j'ai retrouvées dans mes grimoires ... On peut, à partir de ces données, calculer les masses dissoutes par 100 g d'eau. Exemple pour le sucre :
A 0 °C, 100 g de solution contiennent 64,18 g de sucre et donc 35,82 g d'eau ; donc 100 g d'eau dissolvent 64,18*100/35,82 = 179,17 g de sucre. De même, à 100 °C, 100 g d'eau dissolvent 82,97*100/(100-82,97) = 487,2 g de sucre. L'influence de la température sur la solubilité est beaucoup plus forte pour le sucre que pour le sel.
Attention : la température joue aussi sur la vitesse de solubilisation. Une augmentation de température accélère toujours la solubilisation.
Dans le graphique et le tableau ci-dessous, le sel est du chlorure de sodium, et le sucre de la saccharose.
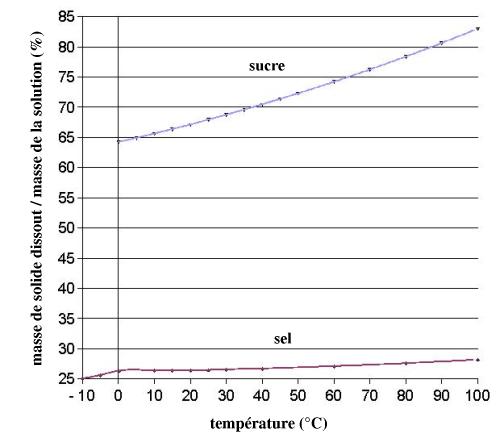
| température (°C) | masse de sel dissout/masse de la solution (%) |
masse de sucre dissout/masse de la solution (%) |
| -10 | 25 | |
| -5 | 25,6 | |
| 0 | 64,18 | |
| 0,1 | 26,3 | |
| 5 | 64,87 | |
| 10 | 26,34 | 65,58 |
| 15 | 26,34 | 66,33 |
| 20 | 26,4 | 67,07 |
| 25 | 26,43 | 67,89 |
| 30 | 26,52 | 68,7 |
| 35 | 69,55 | |
| 40 | 26,67 | 70,42 |
| 45 | 71,32 | |
| 50 | 72,25 | |
| 60 | 27,07 | 74,18 |
| 70 | 76,22 | |
| 80 | 27,55 | 78,36 |
| 90 | 80,61 | |
| 100 | 28,15 | 82,97 |
[Ndlr]
Nos ressources en lien avec ce sujet :
L'eau et la dissolution à l'école maternelle
Les flacons mystérieux
Vous souhaitez aborder ce sujet avec vos élèves ?
Consultez nos ressources pour la classe !









Je n'ai pas les données sous la main. Cependant, il faut savoir qu'une bonne mesure de la solubilité est délicate à réaliser.
En effet, la vitesse de dissolution peut être longue, surtout quand on approche la saturation. En règle générale, il faut une agitation pour accélérer le processus de dissolution, ce qui rend délicate l'observation des cristaux de sels non dissous dans le bain. Au laboratoire, on peut aussi accélérer la dissolution en plongeant la solution dans un bain à ultrasons. Attention, l'utilisation de ce matériel requiert la mise en œuvre de certaines règles de sécurité.
Une petite idée : il peut être intéressant de procéder de la manière suivante, pour vérifier les données dont vous disposez ; on peut se fixer une valeur de solubilité à vérifier, à une température donnée.
Ensuite, on dissout la quantité de sel correspondant à la saturation (calculée à partir du volume de solution) dans le liquide, en augmentant la température au-delà de la température pour laquelle on souhaite vérifier la solubilité.
Enfin, on laisser refroidir la solution en contrôlant la température avec un thermomètre et on enregistre la température à partir de laquelle on commence à observer les cristaux. Ce procédé permet de s'affranchir de la faible vitesse de dissolution du sel ou du sucre puisque la dissolution est réalisée à chaud. Ensuite, il sera plus facile d'observer les cristaux se former, puisque aucune agitation n'est nécessaire.
Je n'ai pas fait l'expérience et je ne peux pas vous dire si cette méthode donne de meilleurs résultats, mais cela vaut peut être la peine d'essayer !
[Ndlr]
Nos ressources en lien avec ce sujet :
L'eau et la dissolution à l'école maternelle
Les flacons mystérieux