Après s'être questionnés sur la base de l'histoire du Capitaine Cook, les élèves explorent les propriétés de l'eau lors de son passage de l'état liquide à l'état solide : volume occupé, flottaison, comparaison avec d'autres types de matières... Ils s'initient également à la représentation moléculaire de l'eau sous ses différents états.
Dans ce document, un enseignant rapporte le déroulé d’une séquence d’activités qu’il a menée en classe - réactions des élèves, difficultés rencontrées, conseils aux autres enseignants... Ces témoignages peuvent être utiles à la fois dans le cadre de la préparation d’une séquence ou activité de classe, ou servir de matière aux enseignants pour construire leurs propres activités de classe.
Notions et connaissances travaillées : Décrire les états et la constitution de la matière à l’échelle macroscopique
Disciplines : Sciences et technologie; Physique (Collège)
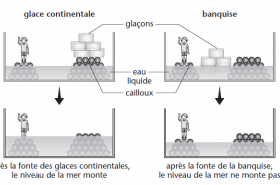
Message à emporter : L'eau possède des propriétés étonnantes. Ainsi, elle « prend plus de place » (elle se dilate) lorsqu’elle gèle, contrairement à presque tous les autres liquides. Ceci explique que des conduites d’eau éclatent parfois en hiver et que l’on ne doive pas mettre des bouteilles remplies d’eau et fermées au congélateur. C'est ce que l'on appelle l’« anomalie » de l'eau.
Cette séquence est extraite des activités du site Sonnentaler, site miroir en Allemagne du site Internet de La main à la pâte. Elle a été créée à l'Université technique de Braunschweig, dans le cadre de la licence (bachelor) de Melanie Schultalbers, au sein du groupe de didactique de la physique du Professeur Rainer Müller. Accéder à la séquence en allemand sur le site Sonnentaler
Il ne s'agit bien entendu pas d'une séquence directement conçue pour l'enseignement des programmes français. Néanmoins, les enseignants français pourront constater que les objectifs de cette séquence ne sont pas si éloignés des leurs et ils sauront tirer le meilleur profit des activités proposées.
L'eau possède des propriétés étonnantes. Ainsi, elle « prend plus de place » (elle se dilate) lorsqu’elle gèle, contrairement à presque tous les autres liquides. Ceci explique que des conduites d’eau éclatent parfois en hiver et que l’on ne doive pas mettre des bouteilles remplies d’eau et fermées au congélateur. C'est ce que l'on appelle l’« anomalie » de l'eau.
Cette séquence a pour objectifs que les enfants se familiarisent avec cette propriété exceptionnelle de l'eau, qu’ils l’étudient par quelques expériences et qu’ils apprennent à reconnaître ses fondements de manière ludique.
Est fournie en complément de cette séquence un éclairage scientifique pour les enseignants. Celui-ci explique le phénomène et ses causes de manière plus précise.
Cette séquence a été créée à l'Université technique de Braunschweig, dans le cadre de la licence (bachelor) de Melanie Schultalbers, au sein du groupe de didactique de la physique du Professeur Rainer Müller.
Déroulement possible de la séquence
La durée des séances est de 90 minutes ; en effet, lors de la conduite d’expériences nécessitant la réalisation d’un mélange réfrigérant, l’observation des résultats de l’expérience ne peut être fructueuse qu’après environ 60 minutes, temps nécessaire au processus de solidification.Notes pour les enseignants
L'avantage d'un mélange réfrigérant est que les élèves peuvent voir ce qui se passe : ceci est impossible avec un réfrigérateur. Si vous allez acheter de la glace pilée dans un commerce de boissons, vous avez immédiatement une grande quantité de glace et le mélange réfrigérant est plus facile à réaliser. Prenez garde à ne pas employer de sel de déneigement, au cas où il viendrait aux enfants l’idée de le goûter.
Séance 1
1. Entrée en matière avec l’histoire de l’expérience du Capitaine Cook. Formulation d’une question : « Qu’arrive-t-il à la glace dans les tonneaux ? »2. « Comment peut-on le vérifier? » Elaboration d’un montage expérimental approprié (par exemple l’expérience du Capitaine Cook).
3. Mise en œuvre de l’expérience du Capitaine Cook et de l'expérience « le Pôle Nord dans un verre d’eau ».
4. Retranscription du montage expérimental, des hypothèses, observations et conclusions dans le cahier d’expériences.
Séance 2
1. Formulation d'une question: « Que se passe-t-il quand l'eau gèle dans un récipient fermé? »2. « Comment peut-on le vérifier? » Elaboration d’un montage expérimental approprié (par exemple « De la glace dans une bouteille »).
3. Mise en œuvre des expériences « De la glace dans une bouteille » et « La glace a besoin de place ».
4. Retranscription du montage expérimental, des hypothèses, observations et conclusions dans le cahier d’expériences.
Séance 3
1. Formulation d'une question: « Toutes les matières se dilatent-elles lors de la solidification ?» Il s’agit d’une considération importante pour lutter contre les représentations erronées, car l’objectif de la séquence est de montrer l’anomalie de l’eau.2. « Comment peut-on le vérifier? » Elaboration d’un montage expérimental approprié (« Collines de glace et vallées de cire »)
3. Réalisation de l'expérience « Collines de glace et vallées de cire ».
4. Retranscription du montage expérimental, des hypothèses, observations et conclusions dans le cahier d’expériences.
Séance 4
1. Formulation d'une question: « La glace flotte-t-elle sur l’eau ? Qu’en est-il de la cire solide dans la cire liquide ? »2. « Comment peut-on le vérifier? » Elaboration d’un montage expérimental approprié (« La bougie qui coule, le glaçon qui flotte »).
3. Réalisation de l'expérience « La bougie qui coule, le glaçon qui flotte ».
4. Retranscription du montage expérimental, des hypothèses, observations et conclusions dans le cahier d’expériences.
Séance 5
1. Formulation d'une question: « Les glaçons flottent-ils toujours à la surface de l’eau ? »2. « Comment peut-on le vérifier? » Elaboration d’un montage expérimental approprié (« Des glaçons qui coulent »).
3. Réalisation de l'expérience « Des glaçons qui coulent ».
4. Retranscription du montage expérimental, des hypothèses, observations et conclusions dans le cahier d’expériences.
Séance 6
1. Introduction du modèle (voir l'introduction pour les enseignants). Il est important de montrer les limites du modèle pour éviter les représentations erronées.2. Fabrication de petits bonshommes à l’aide de nettoie-pipes [c’est juste !], agencement [assemblage ?] en molécules d'eau et en cristaux de glace (formation d’anneaux hexagonaux dans le plan et dans l'espace).
Séance 7
1. Introduction de l’analogie sous forme de jeu.2. Elaboration des règles du jeu (A quoi ressemble une molécule d’eau ? [structure tétraédrique] Comment les molécules sont-elles disposées ? [formation de liaisons hydrogène] Combien de temps perdure la liaison intermoléculaire à l’état liquide et à l’état solide ? [liaison à court terme à l’état liquide, durable à l’état solide])
3. Mise en œuvre du jeu selon les règles convenues précédemment.
Séance 1
L'expérience du Capitaine Cook

Le "Gorch Fock" au milieu des icebergs, © Bundeswehr / Bednarzik
Pour les navigateurs, l’approvisionnement en eau potable fraîche a toujours été d’une importance capitale, car on ne peut boire de l’eau de mer. En 1773, un moyen particulier pour s’approvisionner en eau fut trouvé par l’expédition du Capitaine James Cook, qui avait pénétré dans l’Antarctique au cours de son voyage d’exploration autour du monde. Georg Forster, un des participants de l'expédition, rapporte :
« Au neuvième matin, on vit une grande île de glace, entourée de beaucoup de fragments détachés, et comme nous avions un vent tempéré, il fut résolu de mettre une embarcation à l’eau pour récolter autant de fragments que possible. Ces blocs furent ensuite jetés sur le pont arrière du navire, brisés en morceaux et enfermés dans des fûts. Après les repas, nous en laissions fondre des morceaux dans des cuvettes, et nous déversions quelque chose de chaud sur ce qui restait dans les fûts afin que cette glace puisse fondre également. L’eau que nous récupérions à partir de la glace fondue était très douce et avait un goût plus pur que celle du Cap que nous avions en stock [...]
Quelques personnes à bord, qui ne devaient pas avoir de connaissances en matière de physique, s’inquiétaient sérieusement, pensant que la glace, une fois fondue, ferait exploser les tonneaux dans lesquels elle était enfermée. Ils n’avaient pas considéré que, comme la glace flotte sur l’eau, elle prend donc plus de place que l’eau. Pour leur ouvrir les yeux, le Capitaine… »
L’enseignant devra assurément aider les enfants à « déchiffrer » ce texte. Les enfants peuvent alors réfléchir en petits groupes pour essayer de poursuivre le récit, par exemple. Les différentes fins peuvent ensuite être présentées à l’ensemble de la classe et discutées.
Comment pourrait-on représenter en classe ce qui s’est passé avec les fûts du Capitaine Cook ? Toutes les propositions sont collectées et examinées. Une expérience possible est décrite ci-dessous.
L’expérience du Capitaine Cook
Matériel :
• Un verre contenant de l’eau gelée
• (Une casserole d’eau)
• (1 plaque de cuisson)
Elaboration et réalisation de l’expérience
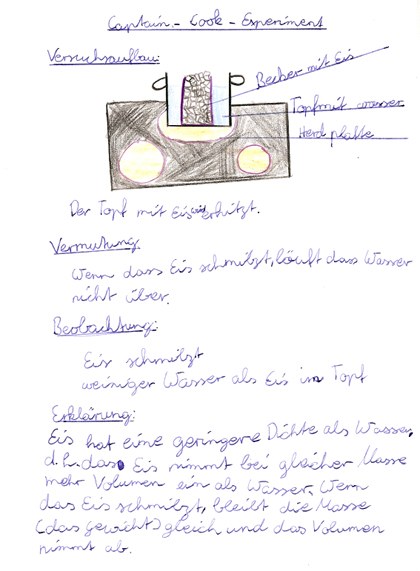
Le verre d’eau gelée est placé dans la casserole d’eau. Le tout est ensuite chauffé avec précaution.
Extrait d'un cahier d'expériences
Observation
Non seulement l’eau n’a pas débordé du verre , mais de plus, le volume de l'eau est inférieur au volume initial de la glace.
Explication
La densité de la glace est plus faible que celle de l’eau, c’est-à-dire que la glace occupe un plus grand volume que l’eau à masse donnée. Si la glace fond, la masse reste la même, mais la densité augmente. C’est la raison pour laquelle le volume diminue.
C’est exactement ce que fit le Captaine Cook. Le rapport de Georg Forster continue ainsi :
« Pour leur ouvrir les yeux, le Capitaine Cook fit porter un récipient rempli de petits morceaux de glace au chaud dans une cabine, où la glace fondit petit à petit et prit moins de place qu’auparavant... »

Expérience du Capitaine Cook : avant et après
On peut montrer que la glace a une densité inférieure à celle de l’eau de manière impressionnante grâce à une autre expérience. Les enfants ne penseront problablement pas d’eux-mêmes à l’expérience « Le pôle Nord dans un verre d’eau » ; dans ce cas, l’enseignant pourra leur décrire le montage expérimental et sa réalisation. Les enfants peuvent néanmoins réaliser les étapes suivantes (formulation d’une hypothèse, réalisation de l’expérience, discussion en petits groupes, trace écrite dans le cahier d’expériences) de façon autonome.
Le pôle Nord dans un verre d’eau
Matériel
• 1 verre
• de l'eau chaude
• 1 glaçon
• éventuellement des pièces de monnaie
Elaboration et réalisation de l’expérience
On remplit le verre d’eau chaude presque jusqu’au bord. Le glaçon est ensuite placé dans l’eau avec précaution. Enfin, on remplit le verre à ras bord, soit en ajoutant de l’eau à l’aide d’une cuillère, soit en ajoutant doucement des pièces de monnaie.

Extrait d'un cahier d'expériences
Observation
Le glaçon fond, et l’eau du verre rempli à ras bord ne déborde pas.
Explication
En raison de la densité moindre de la glace en comparaison avec l’eau, la glace occupe un volume supérieur pour une même masse. Lorsque la glace se trouvant sous la surface de l’eau fond, elle occupe donc un volume moindre, et le niveau de l’eau diminue. La glace qui se trouve au-dessus de la surface de l’eau fond également, de sorte que le verre est rempli d’eau à ras bord.

Le pôle Nord dans un verre d’eau
Séance 2
De la glace dans une bouteille
Que se serait-il passé s’il y avait eu de l’eau liquide dans les fûts, et que celle-ci avait gelé ensuite ? Après une discussion en classe entière, les enfants réfléchissent pour savoir comment vérifier leurs suppositions. Des expériences possibles sont présentées ci-dessous.Matériel
• 1 petite bouteille en verre (100-250 ml) avec bouchon à vis fixe
• De l’eau
• Un petit seau
• Mélange réfrigérant (mélange de glace et de sel dans un rapport 2:1)
Elaboration et réalisation de l’expérience
La bouteille en verre est remplie à ras bord d’eau froide, puis fermée à l’aide du bouchon à vis. La bouteille est alors placée tête en bas dans le seau et entièrement entourée de mélange réfrigérant.

Extrait d'un cahier d'expériences
Observation
La bouteille explose au bout d’une heure environ.
Explication
L’eau occupe un volume plus important à l’état solide qu’à l’état liquide. Comme la bouteille en verre est bien fermée, elle explose pendant le processus de solidification.

De la glace dans une bouteille
La glace a besoin de place
Matériel
• Un œuf-surprise avec œuf en plastique à l’intérieur
• 1 seringue à usage unique
• De l’eau
• Un seau
• (Compartiment) congélateur ou mélange réfrigérant (mélange de glace et de sel dans un rapport 2:1)
Elaboration et réalisation de l’expérience
On remplit entièrement l’œuf en plastique avec de l’eau, en plongeant les deux moitiés dans un seau rempli d’eau et en refermant l’œuf sous l’eau. On remplit d’eau la seringue et on bouche l’extrémité. L’œuf en plastique et la seringue sont ensuite placés dans le congélateur ou dans le mélange réfrigérant.
Observation
Les deux moitiés de l’œuf en plastique se sont écartées, et on peut voir la glace au milieu. On peut lire une augmentation du volume sur la graduation de la seringue.
Explication
L’eau occupe un volume plus important à l’état solide qu’à l’état liquide. Comme l’œuf en plastique est entièrement rempli d’eau, il s’ouvre lors du processus de solidification.

Œuf-surprise, avant et après la congélation
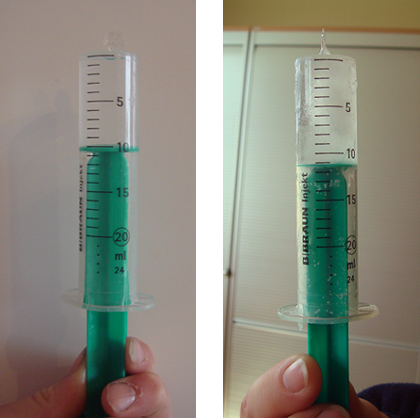
Seringue à usage unique, avant et après la congélation
Liens avec la vie quotidienne
Qui n’a pas déjà observé de craquelures sur une route goudronnée ? De l’eau pénètre sous la chaussée par des fissures. En hiver, cette eau gèle, prenant alors plus de place et faisant « éclater » la couche d’asphalte.
Séance 3
Est-ce que tous les « liquides » prennent plus de place à l’état solide qu’à l’état liquide ? Quels liquides – en dehors de l’eau et des liquides composés d’eau en grande partie (lait, limonade etc.) – les enfants connaissent-ils bien ? Les enfants ont-ils déjà observé ce qui se passe avec la cire liquide autour de la mèche, après avoir soufflé une bougie ? Comment pourrait-on vérifier ce qui se passe dans le cas de ces « autres » liquides ?L’enseignant écrit les propositions des élèves au tableau. Les propositions sont ensuite examinées une par une en classe entière. Une expérience possible est présentée ci-dessous.
Collines de glace et vallées de cire
Matériel
• 2 bouchons métalliques à vis pour bouteille (type Perrier)
• De la cire fondue
• De l’eau
• Congélateur ou mélange réfrigérant (mélange de glace et de sel dans un rapport 2:1)
Elaboration et réalisation de l’expérience
On remplit l’un des bouchons de métal à ras bord avec de la cire liquide, et l’autre avec de l’eau. Tandis qu’on observe le couvercle contenant de la cire liquide à température ambiante, on place le couvercle contenant de l’eau au congélateur ou dans un mélange réfrigérant. Attention à ne pas poser le couvercle sur un matériau qui est un bon isolant thermique, mais sur le fond du compartiment congélateur, ou sur quelque chose qui est déjà gelé et qui contient beaucoup d’eau.

Extrait d'un cahier d'expérience
Observation
Tandis que la cire solidifiée a formé un creux (une vallée), la glace a formé une petite bosse (une colline).
Explication
Lorsque la cire se solidifie, elle prend un volume plus petit qu’à l’état liquide, ce qui signifie que le niveau de cire liquide baisse lors de la solidification, et un creux apparaît. A l’inverse, l’eau occupe un plus grand volume à l’état solide, ce qui signifie que le niveau de l’eau monte lors du processus de solidification, et une bosse apparaît.

Colline de glace et vallée de cire
Séance 4
« La bougie qui coule, le glaçon qui flotte » est une autre expérience permettant de montrer que l’eau se comporte différemment des autres liquides. Peut-être cette expérience aura-t-elle déjà été proposée par les enfants au début de la séance 3. Si ce n’est pas le cas, l’enseignant peut à nouveau guider les enfants, en leur faisant remarquer les glaçons qui flottent dans l’eau (séance 1). Les enfants penseront probablement d’eux-mêmes à regarder ce qui se passe lorsque l’on met de la cire solide dans de la cire liquide (ou des « glaçons » d’huile dans de l’huile).Si vous voulez réaliser l’expérience avec de l’huile, il est conseillé de verser l’huile sur un récipient plat que l’on place au congélateur. La consistance de l’huile gelée s’approche de celle de la glace alimentaire (du moins aux températures régnant dans un congélateur), de sorte que la méthode la plus aisée consiste à prélever de petites « portions d’huile » de la masse congelée à l’aide d’une petite cuillère. L’expérience doit également être d’une durée assez courte, car l’huile gelée fond très rapidement.
La bougie qui coule, le glaçon qui flotte
Matériel
• 2 verres
• De l’eau
• Des glaçons
• De la cire liquide
• Des restants [?] de bougies
Elaboration et réalisation de l’expérience
On remplit l’un des verres d’eau, et l’autre de cire liquide. On met alors un glaçon dans le verre d’eau et un morceau de bougie dans le verre rempli de cire liquide.

Extrait d'un cahier d'expérience
Observation
Alors que le glaçon flotte dans l’eau, le morceau de bougie coule dans la cire liquide.
Explication
La glace, ayant une densité plus faible que l’eau, flotte. La cire solide, ayant une densité supérieure à celle de la cire liquide, coule.

« La bougie qui coule, le glaçon qui flotte »
Séance 5
L’enseignant pose une question « difficile » aux enfants : « Avez-vous une idée pour faire couler les glaçons ? » L’enseignant écrit cette fois-ci aussi les propositions des enfants au tableau, et les laisse en discuter. L’expérience suivante pourrait être une des propositions faites par les enfants.Des glaçons qui coulent
Matériel
• De l’eau
• De l’huile
• 3 glaçons
• 3 verres
Elaboration et réalisation de l’expérience
Deux des verres sont remplis (à un tiers de leur hauteur environ) d’eau et d’huile respectivement. Dans le troisième verre, on met d’abord de l’eau puis de l’huile. Enfin, les glaçons sont déposés dans les verres avec précaution.

Extrait d'un cahier d'expérience
Observation
Dans le verre rempli d’eau, le glaçon flotte. Dans le verre rempli d’huile, le glaçon coule. Dans le verre rempli d’eau et d’huile, le glaçon traverse l’huile et s’arrête à la frontière entre huile et eau.
Explication
La glace a une densité plus faible que l’eau liquide, c’est pourquoi elle flotte (sur [?] l’eau). De même, l’huile a une densité plus faible que l’eau, car elle surnage (mise dans l’eau). La comparaison des densités des trois substances (glace, eau liquide, huile liquide) montre que l’eau, avec 0,998206 g/cm³ à 20°C, a la plus grande densité. La glace a une densité de 0,918 g/ cm³ à 0°C, et l’huile une densité de 0,914 g/cm³.
Comme l’eau a une densité plus faible que la glace, le glaçon coule dans l’huile, et s’enfonce jusqu’à la frontière huile-eau dans le troisième verre.

Des glaçons qui coulent
Séance 6
Cette séance permet de mieux faire réaliser aux enfants pourquoi l’eau se comporte de manière « anormale ». Bien entendu, il est là encore possible que les enfants, répartis en petits groupes, essayent tout d’abord d’en savoir plus sur la molécule d’eau, en recherchant dans des livres et sur Internet. Si l’enseignant manque de temps, il peut mener cette séance et les suivantes en suivant la description ci-dessous.Modélisation avec des cure-pipes
Nous prenons le corps humain pour modéliser la structure d’une molécule d’eau. Les mains représentent les deux atomes d’hydrogène, les pieds les paires d’électrons libres de l’oxygène. Si l’on écarte bras et jambes de façon à établir un angle de 90° à la hanche, on obtient une configuration tétraédrique. Pour représenter les liaisons hydrogène, chaque main peut attraper un pied d’une autre « molécule ».
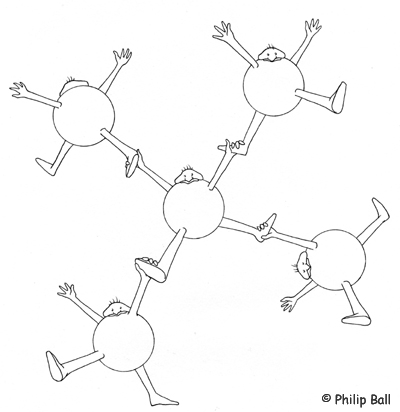
Croquis des « molécules d'eau » se tenant par les mains et les pieds (© Philip Ball)
Le modèle de la molécule d’eau est d’abord expliqué à l’aide de petits bonhommes faits de cure-pipes, car ceux-ci sont plus « flexibles » que le corps humain lorsqu’il s’agit de réaliser un angle de 105° avec les jambes. En outre, la structure de la glace est plus facile à représenter ainsi.
Matériel
• Cure-pipes de trois couleurs différentes

Modèle à l’aide de cure-pipes

Représentation de l'eau (disposition désordonnée des molécules)

Représentation de la glace (formation d’anneaux hexagonaux dans le plan et dans l'espace)
Séance 7
Analogie sous forme de jeuL’analogie sous forme de jeu crée un lien avec le « monde » des élèves. En outre, la participation active des enfants la rend très motivante. En revanche, lorsque l’on emploie une telle analogie, il est important de discuter de ses limites et problèmes, afin de ne pas initier de représentations erronées.

Analogie sous forme de jeu (représentation de la glace - formation des anneaux hexagonaux dans le plan)
Conseil(s) :
Ne pas utiliser de sel de déneigement pour le mélange réfrigérant.
Une sélection de ressources pour enseigner chaque notion scientifique aux programmes scolaires du BO !

Découvrez L@map, la plateforme de formation en ligne pour les professeurs du premier degré et du collège.